SWR2 Impuls Interview mit Samuel Kilcher, Mikrobiologe und Mitglied des Forschungsteams aus Zürich, von der ETH Zürich und dem Universitätsklinikum Balgrist.
Blasenentzündungen sind eine oft schmerzhafte Angelegenheit, die, wenn sie sich auf die Nieren oder darüber hinaus ausbreitet, auch gefährlich werden kann. In der Mehrzahl sind Frauen davon betroffen, aber sie kommen auch bei Männern vor.
Ein Problem bei solchen Harnwegsinfektionen ist, dass es mit der derzeitigen Diagnostik oft mehrere Tage dauert, um festzustellen, welcher konkrete Erreger da am Werk ist. Solange verschreiben Ärztinnen und Ärzte meist, quasi blind, ein Antibiotikum. Das führt wiederum dazu, dass Antibiotikaresistenzen bei Harnwegsinfekten zunehmen.
Abhilfe könnte jetzt aus der Schweiz kommen. Ein Forschungsteam aus Zürich von der ETH und der Universitätsklinik Balgrist haben sowohl eine Art Schnelltest für Harnwegsinfekte entwickelt als auch einen neuen Therapieansatz. Beides auf der Grundlage von sogenannten Bakteriophagen. Die Ergebnisse sind kürzlich in der Fachzeitschrift Nature Communications erschienen.

Unspezifische Antibiotikagabe
Martin Gramlich, SWR2: Warum dauert es mehrere Tage, bis eine Blasenentzündung diagnostiziert und der verantwortliche Erreger identifiziert werden kann?
Samuel Kilcher, Mikrobiologe: Der Hauptgrund dafür liegt darin, dass die Diagnostik über Kulturen gemacht wird. Und das bedeutet, dass eine Urinprobe des Patienten an ein zentrales Labor geschickt wird. Dort werden die Bakterien kultiviert und dann identifiziert, über Massenspektrometrie zum Beispiel oder über selektive Medien. Und das dauert, bis dann wirklich die Resultate zurück im Spital sind typischerweise zwei Tage.
Das bedeutet für den behandelnden Arzt dann auch, dass er in den ersten zwei Tagen ein Antibiotikum verschreiben wird, ohne zu wissen, welches Bakterium die Infektion verursacht hat. Es führt also oft zu einer ungezielten Antibiotikagabe und diese befördert Resistenzen.
Steigende Antibiotikaresistenzen
Martin Gramlich, SWR2: Wie groß ist das Problem?
Samuel Kilcher, Mikrobiologe: Das Problem ist eigentlich sehr groß. Antibiotikaresistenzen nehmen generell zu und auch bei Harnwegsinfekten. Es gibt auch Patienten, die häufig wiederkehrende Harnwegsinfekte haben und deswegen mehrmals pro Jahr mit Antibiotika behandelt werden, das sind zum Beispiel neurologische Patienten. Und in diesen Patienten hat man ganz klar eine Selektion von solchen antibiotikaresistenten Stämmen, weil sie immer wieder Antibiotika ausgesetzt werden.
Neuer Schnelltest mithilfe von Bakteriophagen
Martin Gramlich, SWR2: Sie haben jetzt mit ihren Kolleginnen und Kollegen aus Zürich Alternativen entwickelt, zum einen, einen Schnelltest, der die Erreger schneller identifizieren kann. Wie ist die Idee dazu entstanden? Und wie funktioniert das?
Samuel Kilcher, Mikrobiologe: Die ursprüngliche Idee war es, Phagentherapien zu entwickeln, um Harnwegsinfekte zu behandeln, zusammen mit dem Balgrist Universitätsspital Zürich. Dafür mussten wir erst einmal Methodenentwicklung machen. Es gibt ein Konzept, das schon älter ist und das nennt man Reporterphagen. Das sind Bakteriophagen, die sind genetisch so verändert, dass sie nach der Infektion des Wirtbakteriums ein Protein herstellen, das man messen kann. In unserem Fall zum Beispiel ist es eine sogenannte Luciferase. Das ist ein Enzym, was Licht produziert.
Die Idee dahinter ist ziemlich simpel: Man nimmt den Urin des Patienten und gibt einen Bakteriophagen dazu, der spezifisch einen Erreger erkennen kann, zum Beispiel Escherichia coli, was eben der häufigste Erreger von Harnwegsinfektionen ist. Und diese Phagen wurden genetisch so verändert, dass sie nach der Infektion ein Lichtsignal erzeugen. Und dieses Lichtsignal kann man sehr leicht messen. Das bedeutet: Wir bekommen in kurzer Zeit die Antwort, ob Escherichia coli im Urin vorhanden ist oder nicht. Es dauert so vier bis fünf Stunden.
Bakteriophagen — Viren, die Bakterien infizieren
Martin Gramlich, SWR2: Was genau sind Bakteriophagen?
Samuel Kilcher, Mikrobiologe: Bakteriophagen sind im Prinzip die Krankheitserreger von Bakterien. Sie sind also die natürlichen Fressfeinde von Bakterien. Und was die Bakteriophagen in der Diagnostik wie auch in der Therapie interessant macht, ist Ihre Spezifität. Sie binden ganz spezifisch an Oberflächenproteine, die es nur auf Bakterien gibt und eben auch spezifisch für einzelne Bakterienarten, wie zum Beispiel E. Coli.
Das bedeutet, man bekommt nur dann ein Signal, wenn wirklich dieser Krankheitserreger da ist. Und das ist einerseits natürlich diagnostisch wichtig. Aber auch in der Therapie bedeutet das, dass man sehr spezifisch und zielgerichtet eine einzelne Bakterienart ausschalten kann.
Martin Gramlich, SWR2: Sie arbeiten auch in Richtung Phagentherapien für Harnwegsinfekte. Wie sieht das aus? Oder zu welchen Ergebnissen sind sie da gekommen?
Bakteriophagen wirken unabhängig von Antibiotikaresistenzen
Samuel Kilcher, Mikrobiologe: Unser Interesse daran liegt begründet in der Antibiotikaresistenzkrise, die wir beobachten. Die Antibiotika, die wir typischerweise benutzen, haben ein breites Wirkspektrum. Das bedeutet, dass einerseits Kollateralschäden während der Therapie verursacht werden, es werden also auch die guten oder die gutartigen Bakterien in unserem Ökosystem vernichtet.
Die Bakteriophagen bieten gegen beide diese Probleme eine Lösung. Denn einerseits sind sie extrem spezifisch. Das bedeutet: Man kann ohne Kollateralschäden eine Infektion beseitigen. Und auf der anderen Seite funktionieren die Bakteriophagen eben auch, wenn Bakterien resistent werden. Und das ist so, weil sie einen komplett anderen Wirkmechanismus haben.
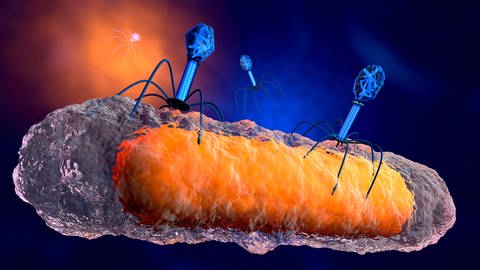
Bakterien leben schon seit knapp dreieinhalb Milliarden Jahren mit Bakteriophagen zusammen. Das bedeutet allerdings auch: sie haben auch gelernt, sich dagegen zu wehren. Bakterien haben auch Immunsysteme und Resistenzsysteme gegen Bakteriophagen. Und deswegen benutzen wir genetic engineering, um die Phagen besser darin zu machen, Bakterien abzutöten, auch wenn sie eigentlich resistent sind.
Phagentherapie war Nischentherapie in letzten 100 Jahren
Martin Gramlich, SWR2: Solche Phagentherapien sind derzeit noch nicht zugelassen in der EU. Warum sind die noch nicht zugelassen, beziehungsweise was bräuchte es, damit sie zugelassen werden?
Samuel Kilcher, Mikrobiologe: Ein Hauptgrund ist, dass wir noch keine klinischen Studien haben, die die Wirksamkeit der Therapie belegen. Und das hat auch damit zu tun, dass wir uns über das letzte Jahrhundert fast zu hundert Prozent auf Antibiotika verlassen haben. Die Phagentherapie führte ein Nischendasein und wurde primär in Osteuropa, zum Beispiel in Georgien, noch verwendet, dort aber ohne klinische Studien und deswegen hat es auch bisher keinen Weg in die westliche Medizin gefunden.
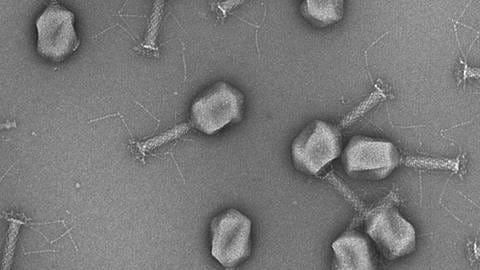
Interesse an Phagentherapien steigt massiv
Martin Gramlich, SWR2: Das heißt, sie haben mit ihrer Untersuchung die Machbarkeit gezeigt. Jetzt geht es darum, das Ganze mit klinischen Studien zu untermauern?
Samuel Kilcher, Mikrobiologe: Genau. Und wir werden eine solche klinische Studie durchführen, zusammen mit dem Universitätsspital Balgrist (Zürich). Wir sind aber bei weitem nicht die einzigen, die sich dafür interessieren. In den letzten zehn Jahren ist das Interesse an der Phagentherapie massiv gestiegen.
Und es gibt zurzeit, denke ich, etwas in der Größenordnung von zehn bis 15 klinischen Studien in verschiedenen Indikationen, in denen die Phagentherapie jetzt nach westlichen Standards getestet wird. Das bedeutet, in den nächsten fünf bis zehn Jahren werden wir die Antwort bekommen, wo und in welcher Form die Phagentherapie auch im Westen Einzug halten kann.